Indsendt af
Statens Serum Institut
Resumé
Vacciner til bekæmpelse af infektionssygdomme er den medicinske opfindelse, der har reddet flest liv, men der er stadig en lang række infektions- og kræftsygdomme, som vi ikke har været i stand til at fremstille effektive vacciner imod. Danmark har en international førerposition inden for basal vaccineforskning, men overførslen fra akademisk forskning og til udvikling og klinisk afprøvning er langsom eller i mange tilfælde ikke eksisterende. Mange af de vacciner som det endnu ikke er lykkedes at udvikle vacciner imod er karakteriseret ved en manglende viden om hvilke immunfaktorer, der korrelerer med vaccineeffekt. Der er derfor ikke noget alternativ til at igangsætte en klinisk afprøvning, hvilket udover den nødvendige investering også kræver adgang til vaccineteknologi samt speciel klinisk ekspertise. I manglen på en struktur der kan varetage denne funktion, bliver en stor del af den værdifulde forskning, der foregår på SSI og i universitetsmiljøet ikke udnyttet effektivt og i værste tilfælde tabt på gulvet.
Vi forslår en satsning, der vil styrke den eksisterende vaccineforskning i Danmark og koble den med en ny og innovativ strategi inden for klinisk afprøvning og high-throughput analytiske platforme (adaptivt trial design). Dette vil muliggøre en accelerering af nye data på effekten af vacciner, hvilket vil have afgørende betydning for en fremtidig vækst indenfor dette vigtige område og konkret føre til:
- Et gennembrud i vores forståelse af immunmekanismer og biomarkører
- Nye vacciner imod vigtige sygdomme af global betydning
- Forøget klinisk afprøvningsekspertise
- Større grad af samarbejde mellem basal vaccineforskning og klinisk forskning
- Viden, IPR og nye kommercielle muligheder for virksomheder og universiteter
Udfordring og muligheder
De vacciner der bruges i dag – eksempelvis vaccinerne imod børnesygdommene – er udviklet op igennem det 19. århundrede. Størstedelen af de vacciner inducerer et antistofsvar, som i mange tilfælde fører til langvarig eller livslang beskyttelse imod sygdom. Vaccinerne er ofte baseret på hele dræbte eller svækkede bakterier eller virus (1. generations vacciner såsom BCG imod tuberkulose og gul feber vaccine) eller oprensede enkelt komponenter (2. generations vacciner såsom difteri og tetanus). Der er dog en lang række sygdomme (HIV, TB, Klamydia, HCV, kræft o.s.v), som det indtil videre har vist sig meget sværere at lave vacciner imod. De fleste af disse sygdomme har et kronisk forløb, og de bliver primært kontrolleret af kroppens såkaldte cellulære immunforsvar (CMI). Grundvidenskabelige gennembrud specielt i de sidste 10 år har åbnet nye muligheder for hvordan vi kan designe moderne vacciner imod netop disse sygdomme, og der findes i dag en lang række nye innovative vacciner og vaccine-teknologier, der har vist imponerende effekt i forskellige dyremodeller. Det næste skridt ville naturligt være en test i mennesker, men i langt de fleste tilfælde stopper al videre udvikling af vaccinen før dette punkt, hvilket skyldes en række forhold som f.eks. 1) manglende viden og ekspertise indenfor vaccineudvikling, 2) begrænset adgang for universiteter til dyr vaccineteknologi fra industrien, 3) manglende økonomiske ressourcer pga. yderst begrænsede muligheder for at få finansieret klinisk forskning i Danmark, 4) manglende interesse fra industriens side før de har set kliniske data.
Vi foreslår at koble forskning og viden på vaccineområdet til nye muligheder for accelereret klinisk afprøvning af vacciner med et såkaldt adaptivt klinisk design som igennem analytiske high-throughput teknologiske (OMICS) platforme muliggør en meget bedre udnyttelse af og generering af data fra de første kliniske afprøvninger. Vi vil etablere humane challenge modeller i de tilfælde, hvor det er etisk forsvarligt (eksempelvis influenza). De opnåede data vil blive anvendt til at optimere design af vaccinerne og den videre kliniske afprøvning. Dermed vil vi ikke alene få eksponeret vaccine-effekten langt hurtigere, men også være i stand til at tiltrække kommerciel interesse på et tidligere tidspunkt enten via licensaftaler eller spin-outs.
Målsætning
Vaccination har – bortset fra rent drikkevand – vist sig at være den sundhedsinvestering, der kan redde flest liv. Det et målet at udvikle den næste generation at vacciner og dermed sikre, at vacciner kan fortsætte med at redde liv i det 20. århundrede. Dette kræver, at vi langt tidligere end i dag får afprøvet vaccinen i mennesker og finder ud af, hvorvidt vaccinen har nogen effekt. Vores målsætning er at styrke overførslen af vacciner fra forskning til klinisk udvikling v.h.a. etablering af et adaptivt klinisk design.
Innovationsbehov
Udvikling af en vaccine fra ren forskning til et produkt, der kan testes i mennesker kræver speciel dedikeret ekspertise, der overholder de gældende guidelines på området. Samtidig har denne langvarige proces betydet, at der i Europa bliver udført færre og færre såkaldte fase I kliniske studier. Der er et betydeligt behov for at styrke den tidlige kliniske forskning på vaccineområdet, således at langt flere forskningsmæssige landvindinger kan testes klinisk. Traditionel klinisk udvikling er karakteriseret ved en meget ressourcetung og langsommelig proces opdelt i en række faser, der først og fremmest fokuserer på sikkerhed og dosisoptimering (fase 1 og 2 studier), og først langt senere i forløbet på effekt (fase 3). Ofte skal man igennem en serie af 6-10 indledende fase 1 og 2 studier, før man finder ud af, hvorvidt vaccinen overhovedet har den beskyttende effekt. Det er af indlysende grunde nærmest umuligt at skaffe finansiering til.
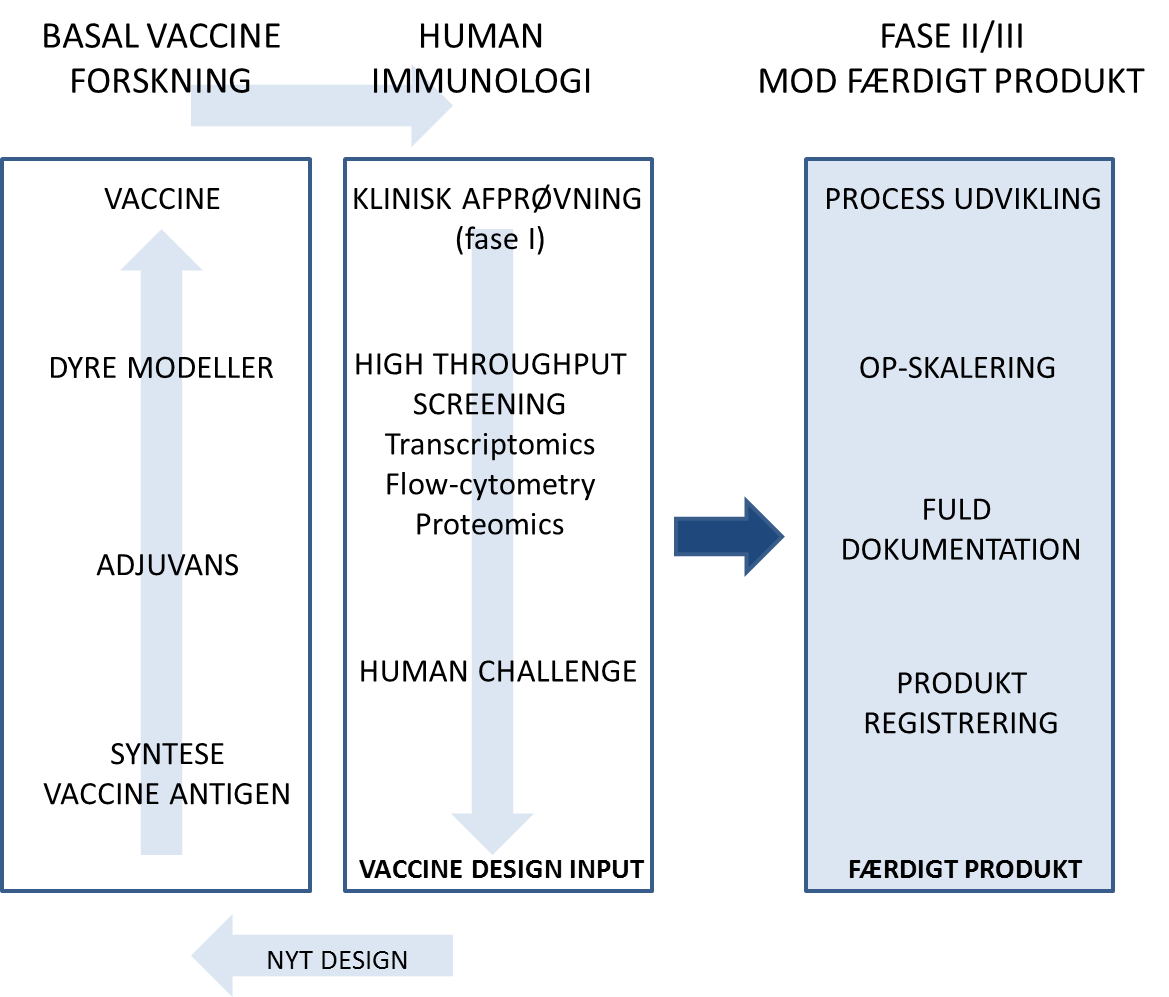
Et adaptivt klinisk design bygger på, at vi tidligt i den kliniske udvikling genererer meget større viden om selve vaccinen v.h.a. high throughput screening og detaljerede analyser af f.eks. blodprøver. Den nye viden vil så blive brugt til at modificere vaccinen eller vaccinationsprotokollen, der så vil blive testet i dyremodeller og derefter hurtigt igen i en ny klinisk fase I afprøvning. I særlige tilfælde kan vi endog give mennesker en challenge med selve mikroorganismen, og dermed få et hurtigt svar på hvorvidt vaccinen beskytter og hvilke immunologiske parametre, der korrelerer med beskyttelsen. Et adaptivt trial design kræver flg.:
Etablering af systembiologi teknologi platforme:
Systembiologi bruger store datamængder til at beskrive sammenhængen mellem alle dele af et biologisk system og samle dem til en helhed. I vaccinesammenhænge kan vi bruge systembiologi til at analysere blodprøver fra patienter med sygdom, vaccinerede patienter og raske kontrolpersoner og dermed få information om, hvilke dele af immunforsvaret som vi skal aktivere med en vaccine, og hvorvidt vaccinen sikkerhedsmæssigt er acceptabel. Det kræver af vi får etableret en bred teknologi platform med analyser på proteinniveau (proteomics) og på genekspressionsniveau (transcriptomics), som samarbejder med de kliniske sites og fokuserer specifikt på vaccineinducerede immunsvar.
Øget tilgængelighed af vaccineudviklingsekspertise og teknologi:
Når en vaccine skal i klinisk afprøvning, kræver det indgående viden omkring eks. GMP-produktion, regulatorisk ekspertise, procesudvikling og eventuelt ny teknologi eks. et vaccineadjuvans, der kan øge immunsvaret af selve vaccineantigenet. Meget ofte vil enten viden eller teknologi ikke være tilgængelig for eksempelvis en universitetspartner. Vi foreslår at skabe et tværfagligt og tværinstitutionelt forum i offentlige regi, der skal hjælpe de forskellige vaccineprodukter videre fra forskning til udvikling.
Styrkelse af den humane kliniske forskning med fokus på vacciner:
Avanceret humanimmunologi udført på de kliniske sites skal bruges til at få maximeret den viden, vi kan få ud af det enkelte kliniske forsøg. Det skal være øget fokus på state-of-the-art metoder, der kan bruges til at undersøge vaccineinduceret immunitet og som er målrettet til klinisk forskning som f.eks. cellesortere, der kan sortere specifikke celler ud af en blodprøve og flowcytometry, der kan bruges til at identificere og undersøge immunforsvarsceller på enkelt-celle-niveau.
Udvikling af humane challenge-modeller:
Der er en række sygdomme, hvor vi basalt set ikke ved, hvilket form for immunsvar, der giver beskyttelse. I nogle tilfælde er det muligt at give en human challenge med selve patogenet, og derved ikke alene få information om vaccinens effektivitet, men også v.h.a. detaljerede immunologiske analyser finde ud af, hvilken del af immunforsvaret det er essentielt at aktivere, og hvordan den næste kliniske afprøvning af produktet skal foretages på den baggrund. Udvikling af en human challenge model vil kun blive foretaget, når det er etisk forsvarligt.
De danske forudsætninger
Traditionelt set har vaccineindustrien ikke været præget af de store indtjeningsmuligheder, og vaccine sektoren repræsenterer kun 2% af hele den pharmaceutiske industri. Men indenfor de sidste fem år er omsætningen af vacciner vokset markant mere end man har set i den øvrige del af den pharmaceutiske sektor, og man taler i øjeblikket om at vaccineindustrien har fået en renæssance. Væksten er primært sket på baggrund af, at to såkaldte blockbustere har ramt markedet hhv. Prevnar imod pneumokokker og Gardasil/Cervarix imod human papilloma virus (HPV). Intensiveret vaccineforskning kan således ikke alene bibringe værdifuld indsigt i sygdomme af stor betydning for verdenssundheden men også potentielt være med til at bringe nye vaccineprodukter med stort økonomisk potentiale på markedet. Det har ført til en stor og fornyet interesse for vaccineområdet fra såvel store pharma-virksomheder som mindre teknologibaserede virksomheder.
Danmark har tradition for at være på forkant med udvikling af vacciner og har flere historiske succeshistorier. Afdelingen for Infektionsimmunologi, SSI, har efter mere end 10 års målrettet arbejde med tuberkulose haft stor kommerciel succes og indgik i 2008 en historisk aftale med Sanofi Pasteur omkring udviklingen af en ny type vaccine imod tuberkulose. Statistikken over indtægter som følge af kommercialisering (udgivet af Forsknings- og Innovationsstyrelsen) afspejler denne succes, idet ca. 60 % af den samlede kommercialiseringsindtægt fra danske offentlige forskningsinstitutioner udgår fra SSI/Afdelingen fra Infektionsimmunologi. Københavns Universitet og SSI har et højt profileret forskningsprogram indenfor malariavaccine udvikling, der har modtaget støtte fra en række fonde som f.eks. Højteknologifonden og Gates Foundation, og i øjeblikket er der flere danske malariavacciner i klinisk udvikling. Professor Søren Buus, Københavns Universitet, er en af pionererne bag udviklingen af high-througput assays, der er blevet brugt til at detektere hvilke af patogenernes proteiner, der kan have interesse at inkludere i en vaccine. Også indenfor det veterinære område udgør vacciner en væsentlig del af det fremtidige satsningsområde, og immunologi/vaccinologi er et af fire indsatsområder for DTU. I forbindelse med det kommende nybyggeri på DTU skal der således bygges en pilot-plant, der gør det muligt at producere veterinære vacciner. Danmark er således i en unik position til at bringe os selv i en førerposition og udnytte det paradigmeskifte, vi står overfor indenfor vaccine forskning og udvikling.
Effekter og potentialer
Ud fra et samfundsmæssigt økonomisk perspektiv er forebyggelse – og i særdeleshed vacciner – et af de mest interessante tiltag. Kan vi også begynde at udvikle terapeutiske vacciner til behandling af kroniske sygdomme, kan vacciner potentielt være med til at redde endnu flere liv.
Ikke alene kan vacciner redde liv, men eksempler fra den danske forskningsverden har også vist, at det kan lade sig gøre at kommercialisere opfindelser fra den danske vaccine-forskning. Adaptivt trial design vil gøre os i stand til langt hurtigere at forudse, hvorvidt en vaccine er beskyttende. Dermed er vejen banet for hurtigere kommercialisering og/eller etablering af spin-outs, der kan tiltrække investor-kapital.